Bolesnici su spremni osjećati se bolje i ponovno se baviti svakodnevnim aktivnostima
Brzi odgovor (ACR50) već u 4. tjednu kod ispitanika koji nisu prije bili na biološkom lijeku4

*Podaci koji nedostaju i podaci za ispitanike koji su prebačeni s placeba na lijek Cosentyx u 16. tjednu imputirani su kao ispitanici koji nisu imali terapijski odgovor.4
Što bi brz i dugotrajan uspjeh liječenja značio za Vas i Vaše bolesnike?
Više od 50 ispitanika koji nisu prethodno primali biološku terapiju postiglo je ACR50 nakon 5 godina s lijekom Cosentyx u dozi od 300 mg5,6
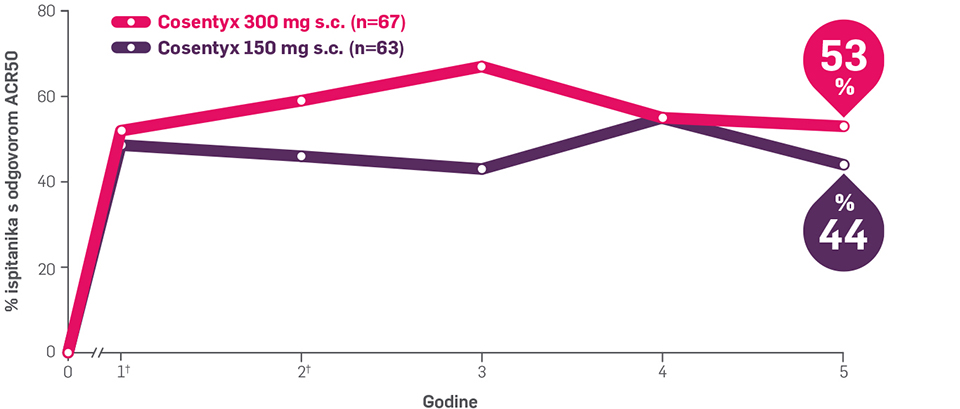
ACR20 postiglo je 80%, odnosno 77% ispitanika koji prethodno nisu bili liječeni biološkom terapijom, s lijekom Cosentyx u dozi od 300 mg (n=67), odnosno 150 mg (n=63) nakon 5 godina liječenja6
ACR
ACR20/50 označava poboljšanje ≥ 20%/50% u broju otečenih zglobova i broju bolnih zglobova te poboljšanje ≥ 20%/50% u najmanje 3 od preostalih 5 domena7
†Podaci koji nedostaju u 52. tjednu imputirani su kao ispitanici koji nisu imali terapijski odgovor. Za podatke koji nedostaju u 104. tjednu korištena je metoda višestruke imputacije.5
Prikazani su opaženi podaci ispitanika u 156., 208. i 260. tjednu prema početnoj randomiziranoj skupini. Skupina Cosentyx 150 mg uključivala je 29 ispitanika u podskupini ispitanika koji nisu prethodno primali biološku terapiju, a kojima se doza lijeka Cosentyxa povisila sa 150 mg na 300 mg u 128. tjednu, prema protokolu.6
Pogledajte nacrt ispitivanja FUTURE 2 i FUTURE 5 (link)

Zahvaćenost aksijalne domene kod bolesnika sa PsA dijagnozom utječe na njihov svakodnevni život
Do 70% bolesnika s dugogodišnjim PsA-om mogu razviti aksijalne simptome8
2 od 3 ispitanika sa psorijatičnim spondilitisom koji prethodno nisu primali biološki lijek osjetilo je značajna poboljšanja aksijalnih simptoma nakon 12 tjedana3,9
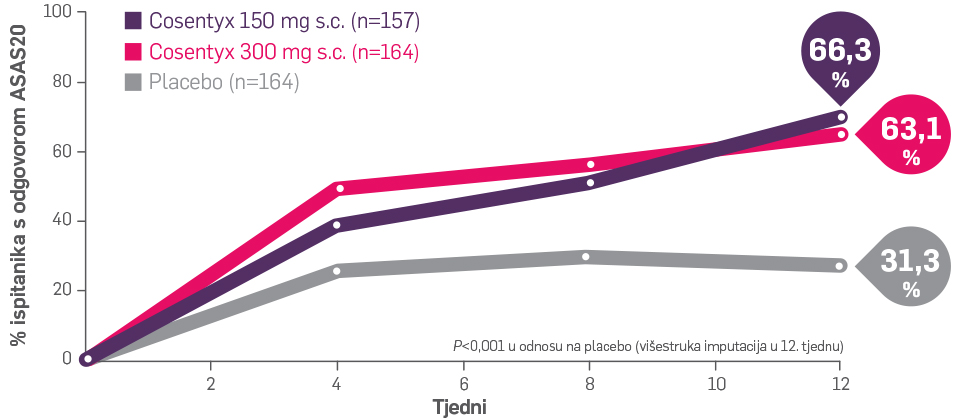
Komponente ASAS odgovora uključuju10: funkcionalnu sposobnost (BASFI), bolesnikovu globalnu procjenu, ukupnu bol i jutarnju zakočenost.
ASAS20 je poboljšanje ≥20% i ≥1 boda (na vizualnoj analognoj skali od 10 bodova) u najmanje 3 od 4 domene i bez pogoršanja ≥20% i ≥1 boda (na vizualnoj analognoj skali od 10 bodova) u preostaloj domeni10
Pogledajte nacrt ispitivanja MAXIMISE (link)
Kad bolesnici brinu za svoju budućnost
Gotovo 80% ispitanika koji prethodno nisu primali TNFi nije imalo progresiju strukturalnog oštećenja nakon 3 godine11*
*Ispitanici sa srednjom promjenom od početne vrijednosti mTSS-a ≤0,5 definirani su kao ispitanici bez progresije.11
Pogledajte nacrt ispitivanja FUTURE 1 (link)
UČINAK NA OSTALE MANIFESTACIJE
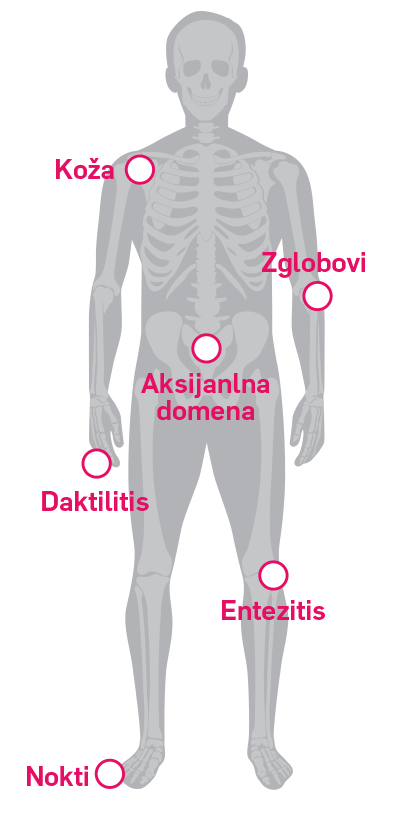
Nokti: The modified Nail Psoriasis Severity Index (mNAPSI), modifikacija NAPSI-ja, je jednostavan i pouzdan numerički alat u procijeni težine psorijaze noktiju.14 Početne vrijednosti mNAPSI-ja bile su 17,4 i 17,6 za Cosentyx 300 mg s.c. i 150 mg s.c. skupine. *Prikazani su opaženi podaci srednje promijene vrijednosti mNAPSI-ja nakon godine dana.13
Daktilitis/Entezitis/Koža: Prikazani su podaci za 150 mg koji uključuje i 83 ispitanika kojima je doza lijeka povišena na 300 g prema procijeni ispitivača od 156. tjedna nadalje. PASI 90: Ispitanici s istodobnom psorijazom i BSA (površina zahvaćene kože) ≥3% na početu ispitivanja (n = 89). Daktilitis: Prikazani su podaci u ispitanika koji su imali daktilitis na početku ispitivanja (n = 83), procijenjeno koristeći Leeds Dactylitis Index. Entezitis: Prikazani su podaci u ispitanika koji su imali entezitis na početku ispitivanja (n = 99), procijenjeno koristeći Leeds Enthesitis Index.12
POSTOJANA KONTROLA BOLESTI KOJA NADILAZI SIMPTOME

HAQ-DI; Početni HAQ-DI za Cosentyx 300 mg bio je 1,318
Ispitanici sa srednjom promjenom od početne vrijednosti mTSS-a ≤0,5 definirani su kao ispitanici bez progresije.11
NACRTI ISPITIVANJA
FUTURE 1
FUTURE 1 je bilo dvostruko slijepo, placebom kontrolirano ispitivanje faze III koje je uključivalo 606 ispitanika s aktivnim PsA-om koji su bili randomizirani 1:1:1 na Cosentyx (10 mg/kg i.v. na početku i u 2. i 4. tjednu, nastavno s 150 mg s.c. ili 75 mg s.c. svakih 4 tjedna) ili placebo (prema shemi doziranja).17
Ispitanici u placebo skupini ili su rerandomizirani (1:1) na Cosentyx 75 mg ili 150 mg s.c. svaka 4 tjedna bez udarne doze nakon 16. tjedna (bolesnici bez terapijskog odgovora) ili nakon 24. tjedna (ispitanici s terapijskim odgovorom).17
Primarni cilj ispitivanja bio je postotak ispitanika s ACR20 odgovor u 24. tjednu.17
Osnovno ispitivanje je trajalo 2 godine nakon čega je uslijedio produžetak ispitivanja u trajanju od 3 godine.11
U ispitivanje je bilo uključeno 70% ispitanika koji prethodno nisu bili liječeni biološkom terapijom.17
FUTURE 2
FUTURE 2 je bilo multicentrično, randomizirano, dvostruko slijepo, placebom kontrolirano ispitivanje faze III koje je uključivalo 397 odraslih ispitanika s aktivnim PsA-om (≥3 otečeni i ≥3 bolni zglobovi) usprkos uporabi NSAID-a ili csDMARD-ova.16
Ispitanici su primali Cosentyx 150 mg, 300 mg ili placebo supkutano u 0., 1.,2.,3. i 4. tjednu te nakon toga svaka 4 tjedna. Ispitanici koji su primali placebo su rerandomizirani na Cosentyx 150 mg ili 300 mg svaka 4 tjedna u 16. ili 24. tjednu ovisno o odgovoru na placebo.16
Primarni cilj ispitivanja bio je postotak ispitanika s ACR20 odgovorom u 24. tjednu.16
U ispitivanje je bilo uključeno otprilike 65% ispitanika koji prethodno nisu bili liječeni biološkom terapijom te 47% ispitanika koji su istodobno liječeni metotreksatom.16
FUTURE 5
FUTURE 5 je bilo multicentrično, randomizirano, dvostruko slijepo, placebom kontrolirano ispitivanje faze III koje je uključivalo 996 odraslih ispitanika s aktivnim srednje teškim do teškim PsA-om. Ispitanici su randomizirani na Cosentyx 150 mg bez udarne doze (n=222), 150 mg s udarnom dozom (n=220), 300 mg s udarnom dozom (n=222) ili placebo (n=332). Ispitanici koji su primali placebo bili su rerandomizirani na Cosentyx (150 mg ili 300 mg svaka 4 tjedna) ovisno o terapijskom odgovoru u 16. tjednu (ispitanici bez terapijskog odgovora) ili u 24. tjednu (ispitanici koji su imali terapijski odgovor).4
Primarni cilj ispitivanja bio je postotak ispitanika s ACR20 odgovorom u 16. tjednu.4
Sekundarni cilj ispitivanja uključivao je promjenu mTSS u 24. tjednu od početne vrijednosti, ACR50 odgovor i udio ispitanika s potpunim povlačenjem daktilitisa i entezitisa u 16. tjednu te sigurnost i podnošljivost lijeka.4
U ispitivanje je bilo uključeno 70% ispitanika koji prethodno nisu bili liječeni biološkom terapijom.4
MAXIMISE
MAXIMISE je bilo randomizirano, dvostruko slijepo, placebom kontrolirano, multicentrično, 52- tjedno ispitivanje koja je uključivalo 498 ispitanika s aktivnim PsA-om i zahvačenošću aksijalnog skeleta (definirano kao BASDAI ≥4, spinalna bol VAS ≥40 [0 do 100 mm skala]) koji su imali neadekvatni odgovor na najmanje 2 NSAID-a tijekom 4 tjedna liječenja. Ispitanici su bili randomizirani da primaju supkutano Cosentyx u omjeru 1:1:1, Cosentyx 150 mg (n=165), Cosentyx 300 mg (n=167) i placebo (n=166) u 0., 1., 2., 3., 4. tjednu te potom svaka 4 tjedna. Nakon 12. tjedna ispitanici koji su bili u placebo skupini na početku ispitivanja rerandomizirani su na Cosentyx 150 mg ili Cosentyx 300 mg (1:1), primijenjen svaka 4 tjedna od 12. tjedna do 52. tjedna (zadnja doza lijeka 48. tjedan).3,9
Primarni cilj ispitivanja bio je udio ispitanika s ASAS20 odgovorom na Cosentyx 300 mg s.c. vs placebo u 12. tjednu.9
Glavni sekundarni cilj ispitivanja bio je udio ispitanika s ASAS20 odgovor na Cosentyx 150 mg s.c. vs placebo u 12. tjednu.9
Svi ispitanici u ovom ispitivanju nisu prethodno liječeni biološkom terapijom.9
UPUTA O LIJEKU 75mg UPUTA O LIJEKU 150mg - 300mg
LITERATURA:
- Cosentyx, Novartis Europharm Limited, zadnji odobreni sažetak opisa svojstava lijeka.
- Taltz, Eli Lilly Nederland B.V., zadnji odobreni sažetak lijeka.
- Baraliakos X et al. Ann Rheum Dis. 2019;78. Abstract OP0235.
- Mease P et al. Ann Rheum Dis. 2018;77(6):890-897.
- McInnes IB et al. Rheumatology (Oxford). 2017;56(11):1993-2003.
- McInnes IB et al. Lancet Rheumatol. 2020;2(4):e227-e235.
- Felson DT et al. Arthritis Rheum. 1995;38(6):727-735.
- Feld J et al. Nat Rev Rheumatol. 2018;14(6):363-371.
- Baraliakos X, et al. Ann Rheum Dis. 2020 Dec 17:annrheumdis-2020-218808.
- Anderson JJ et al. Arthritis Rheum. 2001;44(8):1876-1886.
- Mease P et al. RMD Open. 2018;4(2):e00723.
- Mease PJ et al ACR Open Rheumatol. 2020;2(1):18-25
- Nash P et al American College of Rheumatology (ACR) Annual Meeting. 8-13 November 2019; Atlanta, GA, USA. Poster 1485.
- Mease PJ et al Arthritis Care Res (Hoboken). 2011; 63 (suppl 11):S64-S85.
- McInnes IB et al. Arthritis Rheum 2018; 70 (suppl 10). Abstract 2608.
- McInnes IB et al. Lancet. 2015; 386(9999): 1137-1146.
- Mease PJ et al. N Engl J Med 2015; 373(14):1329-1339.
KRATICE:
-
ACR - Američki koledž za reumatologiju;
-
IL - interleukin;
-
s.c - supkutano;
-
ASAS - Međunarodno društvo za procjenu spondiloartritisa;
-
BASFI - Bathov funkcionalni indeks za ankilozantni spondilitis;
-
NSAID - nesteroidni protuupalni lijekovi;
-
mTSS - modificiran ukupni rezultat po Sharpu;
-
i.v - intravenski;
-
TNFi - inhibitor čimbenika nekroze tumora;
-
MMRM - mixed-effect model repeated measure;
-
PASI - Indeks zahvaćenosti kože psorijazom i težina psorijaze;
-
HAQ-DI - Upitnik za procjenu zdravlja – Indeks onesposobljenosti;
-
csDMARD - konvencionalni sistemski antireumatski lijek koji modificira tijek bolesti



