Ispitivanje PREVENT dokazuje učinkovitost, podnošljivost i sigurnost lijeka Cosentyx® i kod nr-axSpA
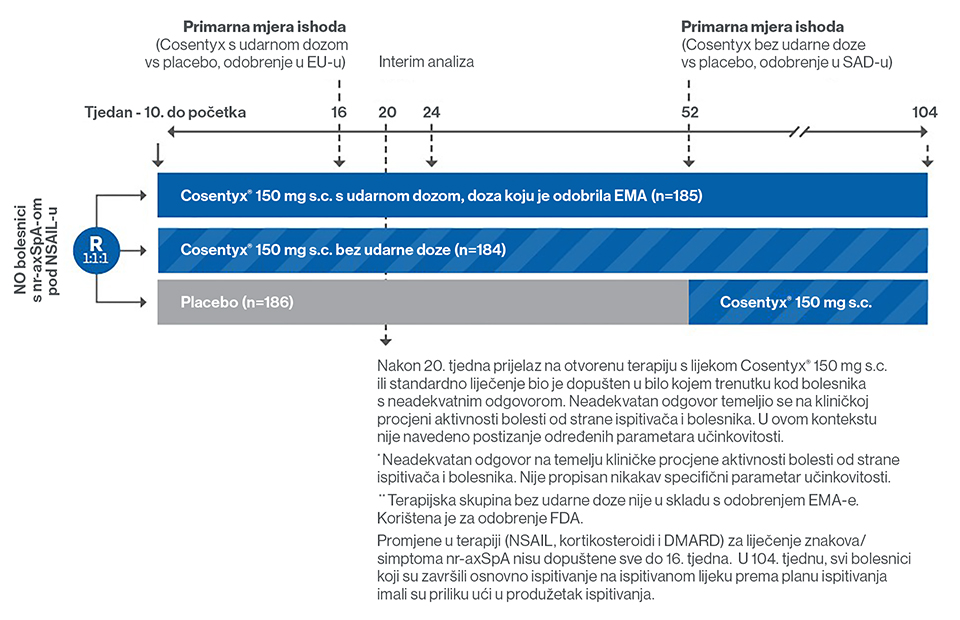
Najvećim kontroliranim ispitivanjem faze III do danas (NCT02696031) provedenim s biološkim lijekom za nr-axSpA procjenjivala se učinkovitost, podnošljivost i sigurnost sekukinumaba 150 mg (s ili bez udarne doze, u odnosu na placebo). Prikazani su prvi dugoročni rezultati za dvije godine.1-3
Pregled glavnih rezultata
- Nakon samo 16 tjedana, 40 % bolesnika koji su primali sekukinumab 150 mg s udarnom dozom u ispitivanju PREVENT imalo je odgovor ASAS40 u usporedbi s 28 % bolesnika koji su primali placebo (p < 0,05).1
- Postotak odgovora ASAS40 dodatno se povećao na 61 % nakon 2 godine sa sekukinumabom 150 mg uz udarnu dozu.2
- Sekukinumab ima dobar i postojan sigurnosni profil. Čak ni nakon 2 godine nije bilo novih ili neočekivanih nuspojava u bolesnika s nr-axSpA-om.1,2
Na temelju ispitivanja PREVENT odobren je Cosentyx®, koji je bio prvi inhibitor interleukina-17A odobren za liječenje cijelog spektra axSpA.2
- Randomizirano dvostruko slijepo, placebom kontrolirano, multicentrično ispitivanje faze III u kojem se ispituju učinkovitost, podnošljivost i sigurnost sekukinumaba za nr-axSpA.
- 555 bolesnika s nr-axSpA-om nasumično je raspoređeno da prima sekukinumab 150 mg s udarnom dozom, bez udarne doze ili placebo.
- Nakon 20 tjedana, liječenje u skupini s promjenom terapije može se nastaviti nemaskirano sa sekukinumabom ili drugom standardnom terapijom prema odluci liječnika i bolesnika.
- Prva analiza nakon 16 tjedana (Plan A za odobrenje u EU-u), druga nakon 52 tjedna (Plan B za odobrenje u SAD-u).
- Primarna mjera ishoda: odgovor ASAS40 u 16. tjednu kod bolesnika koji prethodno nisu primali biološke lijekove u usporedbi s placebom.
- Sekundarne mjere ishoda: odgovor ASAS20, promjena indeksa BASDAI i BASFI, odgovor BASDAI50, promjena hsCRP-a (16. tjedan), promjena rezultata za SF-36-PCS (fizička komponenta), progresija strukturnih promjena na MR-u.
- Podaci o sigurnosti i podnošljivosti procijenjeni su za sve bolesnike koji su primili barem jednu dozu sekukinumaba od 150 mg.
Uključeni su bili
- bolesnici stariji od 18 godina s aktivnom dijagnozom nr-axSpA prema kriterijima klasifikacije ASAS-axSpA, uočljivom aktivnom upalom na MR-u ili značajno povišenim CRP-om (ako je samo CRP bio povišen, tada je bilo potrebno utvrđivanje HLA-B27)
- bolesnici s ukupnim rezultatom za BASDAI ≥ 4 i ukupnim rezultatom za bol u leđima ≥ 40 na vizualnoj analognoj skali (VAS). Prethodni odgovor bio je neadekvatan uz ≥ 2 NSAIL-a unutar 4 tjedna.
- bolesnici koji nisu prethodno primali biološke lijekove ili su prethodno imali neadekvatan odgovor na najviše jedan TNF inhibitor
- također je dopušteno uzimanje sulfasalazina ili metotreksata, glukokortikoida i ≤ 2 NSAIL-a.
- doziranje se nije smjelo mijenjati do 16. tjedna.
Između ostalih, isključeni su bili
- bolesnici s dokazima sakroileitisa prema Njujorškim kriterijima
- bolesnici s aktivnom infekcijom ili zloćudnom bolešću u posljednjih 5 godina
- bolesnici s aktivnim UBC-om (kronična upalna bolest crijeva) neovisno o axSpA-u i/ili uveitisom (n=15). Bolesnici koji su u anamnezi imali UBC ili uveitis mogli su sudjelovati u ispitivanju.
- postojeće, kronične ili rekurentne zarazne bolesti općenito, postojeća HIV infekcija, hepatitis B, hepatitis C ili potvrđena tuberkuloza.
Demografske karakteristike / obilježja axSpA a početku ispitivanja
| Sekukinumab 150 mg s.c. s udarnom dozom (N=185) |
Placebo (N=186) |
|
| Dob (u godinama), srednja vrijednost (SD) | 39,1 (11,5) | 39,3 (11,5) |
| Ženski spol, n (%) | 105 (56,8) | 95 (51,1) |
| Prethodno neliječeni TNF inhibitorima, n (%) | 164 (88,6) | 171 (91,9) |
| Pozitivni na HLA-B27; N (%) | 136 (73,5) | 129 (69,4) |
| Vrijeme od početka bolova u leđima (u godinama), srednja vrijednost (SD) |
8,7 (9,3) | 8,4 (8,3) |
| Ukupna bol u leđima (medijan, 0-100 mm) | 74,0 | 71,0 |
| BASDAI, srednja vrijednost (SD) | 7,08 (1,3) | 6,76 (1,24) |
| BASFI, srednja vrijednost (SD) | 6,2 (2,0) | 5,9 (1,9) |
| Povišeni CRP, n (%) | 104 (56,2) | 105 (56,5) |
| Upala sakroilijakalnog zgloba na MR-u, n (%) | 132 (71,4) | 139 (74,7) |
BASDAI: Bath indeks aktivnosti ankilozantnog spondilitisa; BASFI: Bath funkcionalni indeks za ankilozantni spondilitis; CRP: C-reaktivni protein; HLA-B27: humani leukocitni antigen B27; MR: magnetska rezonancija; N = broj randomiziranih bolesnika po ispitivanoj skupini; n = broj bolesnika; s.c.: supkutano; SD = standardna devijacija;
TNF = faktor nekroze tumora
**Ispitivana skupina bez udarne doze nije u skladu s odobrenjem EMA-e: služila je dobivanju odobrenja od FDA.
Uz sekukinumab 150 mg uz udarnu dozu postignuta je primarna mjera ishoda, odgovor ASAS40:
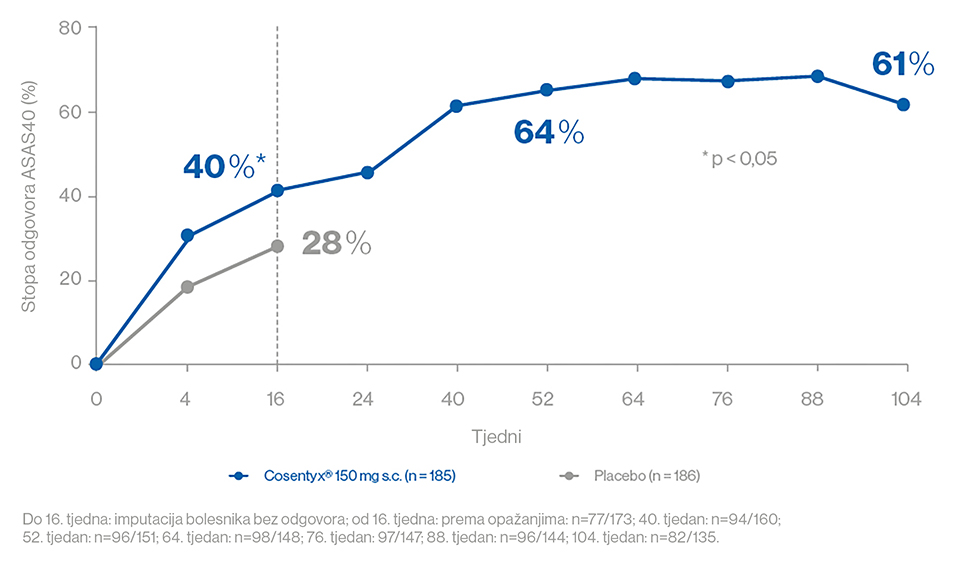
- Odgovor ASAS40 uz sekukinumab 150 mg s udarnom dozom kod bolesnika koji prethodno nisu primali biološke lijekove bio je 41,5 % naspram 29,2 % uz placebo nakon samo 16 tjedana i stoga je bio statistički značajno viši (p < 0,05).1 Nakon 52 tjedna, stopa odgovora ASAS40 iznosila je 66 % i održala se do 104. tjedna (63,4%). Ukupna populacija također prati ovaj trend (Slika 2).1,2
Sekukinumab 150 mg s udarnom dozom (u odnosu na placebo) također je bio značajno bolji u sekundarnim mjerama ishoda:
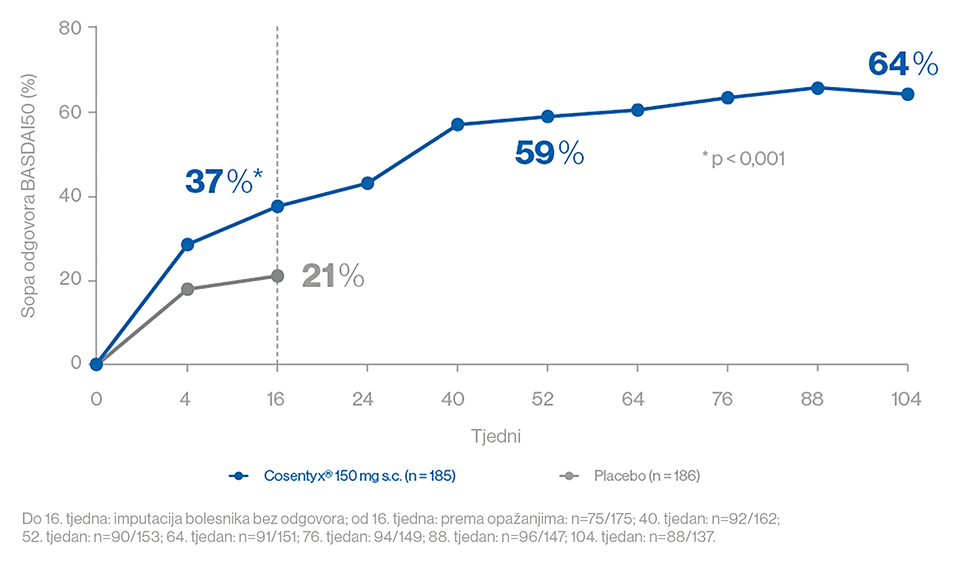
- Odgovor BASDAI50 bio je 37 % u bolesnika koji su primali sekukinumab 150 mg s udarnom dozom u 16. tjednu u usporedbi s 21 % u onih koji su primali placebo (p < 0,001).1 Nakon 2 godine, 64 % bolesnika postiglo je odgovor BASDAI50 (Slika 3).2
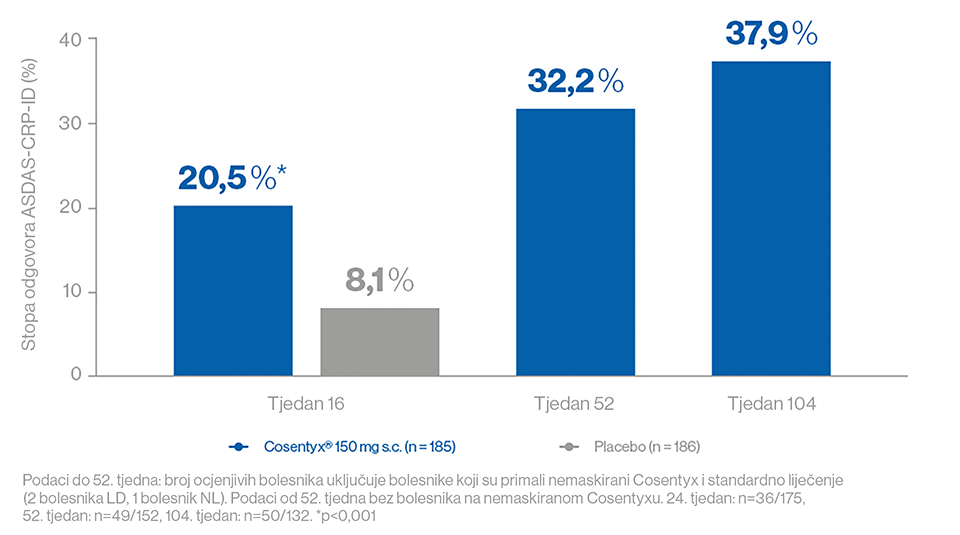
- Nakon samo godinu dana, aktivnost bolesti se više nije mogla otkriti u 32 % bolesnika koji su primali sekukinumab 150 mg s udarnom dozom.1 U 38 % bolesnika koji su primali sekukinumab 150 mg s udarnom dozom, vrijednost ASDAS-CRP bila je ispod 1,3 nakon 2 godini i bolesnici su dakle bili bez aktivnosti bolesti (Slika 4).2
- Postotak ostanka na terapiji bio je visok: 95 % randomiziranih bolesnika bilo je na terapiji sekukinumabom dulje od 24 tjedna, 86,7 % čak dulje od 52 tjedna.1
- Nakon 104 tjedna, gotovo 80 % bolesnika još uvijek je bilo na terapiji sekukinumabom.2
- Nije bilo naznaka novih ili neočekivanih sigurnosnih signala tijekom cijelog razdoblja liječenja.2
- Sigurnosni profil je u skladu s već poznatim profilom iz drugih indikacija.3
Sigurnosni profil tijekom 2 godine
| Sekukinumab, sve doze (N=543)* |
Placebo (N=186) |
|
| Bolesnik-godine | 888,3 |
109,3 |
| Štetni događaji, n (%) | 448 (82,5) | 122 (65,6) |
| Ozbiljni štetni događaji, n (%) | 42 (7,7) | 8 (4,3) |
| Prekid zbog štetnih događaja, N (%) | 25 (4,6) | 3 (1,6) |
| Smrt, n (%) | 0 (0,0) | 0 (0,0) |
| Odabrane nuspojave | ||
| Crohnova bolest, n (EAIR) | 5* (0,6) | 0 (0,0) |
| Ulcerozni kolitis, n (EAIR) | 2 (0,2) | 0 (0,0) |
| MACE, n (EAIR) | 0 (0,0) | 1 (0,9) |
| Uveitis, n (EAIR) | 9 (1,0) | 2 (1,8) |
* Uključuje sve bolesnike koji su primali sekukinumab 150 mg prije početka i nakon ponovne randomizacije.
* Bio je još jedan slučaj Crohnove bolesti koji je bio naveden u bazi kliničkih podataka s ovom dijagnozom a nije ovdje uključen. Dijagnoza je ponovno potvrđena nakon završetka razdoblja ispitivanja.
LITERATURA:
- Deodhar A et al. Improvement of Signs and Symptoms of Nonradiographic Axial Spondyloarthritis in Patients Treated With Secukinumab: Primary Results of a Randomized, Placebo-Controlled Phase III Study. Arthritis Rheumatol. 2021 Jan;73(1):110-1203.
- Poddubnyy D et al. Secukinumab 150 mg Provides Sustained Improvement in Signs and Symptoms of Non-radiographic Axial Spondyloarthritis: 2-year Results from the PREVENT Study. European Alliance of Association For Rheumatology EULAR Annual Meeting 2021. Abstract 143 und zugehöriges Poster POS0900.
- Cosentyx®, Novartis Europharm Limited, zadnji odobreni sažetak opisa svojstava lijeka.

