Otprilike 1 od 3 bolesnice sa stadijem II (N0,N1) ER+ ranog raka dojke (eBC) doživjet će udaljeni recidiv - činjenica koja naglašava nemogućnost današnjeg liječenja da u potpunosti odgovori na potrebe ovih bolesnica.1,2
NEPREPOZNAT RIZIK
U HR+/HER2- eBC
Broj bolesnica sa stadijem II (N0, N1) bolesti i njihova razina rizika je značajna.2,3
Znatan udio bolesnica3

Procjena temeljena prema podatcima iz Surveillance, Epidemiology, and End Results (SEER) registra.
Klasifikacija TNM stadija II
Podcijenjen rizik2

Iako heterogena populacija, sve bolesnice sa stadijem II (N0, N1) ER+ eBC-a su u riziku od udaljenog recidiva.1,2,6
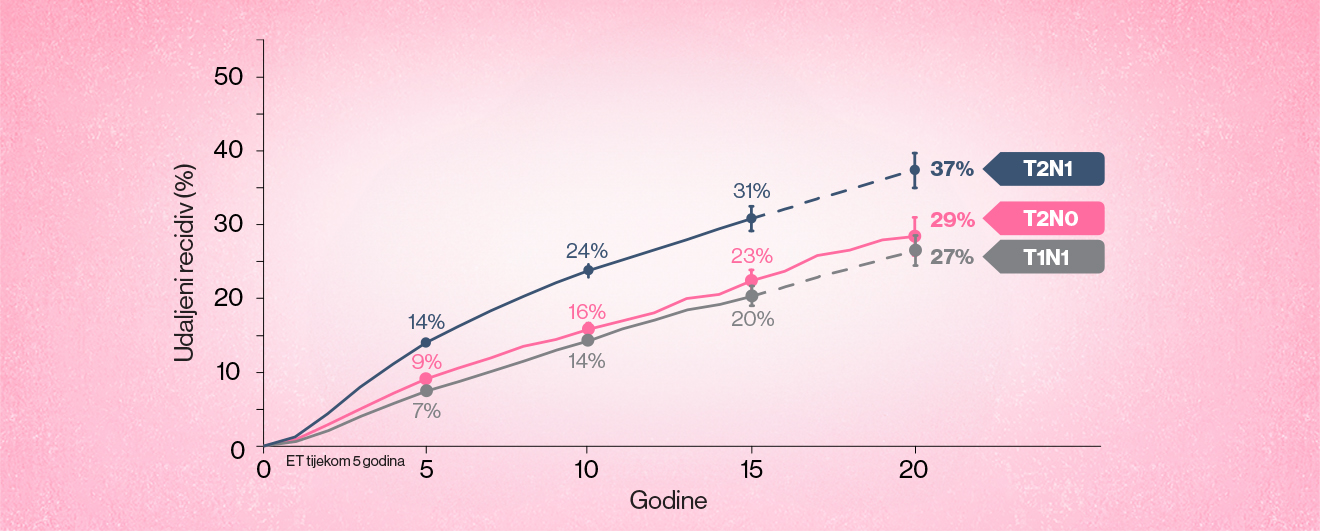
Broj bolesnica u riziku (i, u svakom razdoblju od 5 godina, broj događaja i godišnja stopa)
T2N1
Okomite trakice označavaju 95% interval pouzdanosti (CI). Isprekidane linije označavaju stopu događanja tijekom 5 godina.
Iz meta-analize 78 randomiziranih ispitivanja the Early Breast Cancer Trialistsʼ Collaborative Group (EBCTCG) baze podataka 74,194 žena s ER+ karcinomom dojke koje su tijekom 5 godina primale endokrinu terapiju. Bolesnice s T0 i T3, i N3 bolesti, nisu bile uključene u analizu.¹
Vaše bolesnice sa stadijem II (N0, N1) eBC-a trebaju nove mogućnosti koje učinkovitije smanjuju rizik od recidiva
JAZ U LIJEČENJU
U HR+/HER2- eBC
Praznina u inovacijama u liječenju ostavlja većinu bolesnica sa stadijem II (N0, N1) bolesti bez optimalne terapije.7,8
Nedavno odobrene terapije ograničene su na visokorizično okruženje.7-10

Udio stadija II HR+/HER2- bolesti za koji se procjenjuje da će se riješiti nedavnim napretkom u liječenju.
Iako abemaciklib i olaparib pružaju dodatne mogućnosti, svaki je indiciran za uporabu u <15% bolesnica s eBC3,8,11,12
Postotci izračunati na temelju odobrenja abemacikliba za bolest stadija II ili III s pozitivnim limfnim čvorovima i, za olaparib, prevalencija mutacija BRCA1 i BRCA2 u ER+ raku dojke.
IZAZOVI PODNOŠLJIVOSTI
Podnošljivost i adherencija ostaju izazovi u HR+/HER2- ranom karcinomu dojke13-18
Simptomatske neželjene reakcije povezane su sa:
- Nemogućnosti obavljanja svakodnevnih životnih aktivnosti
- Nepridržavanjem liječenju
- Većim stopama prekida liječenja
U kliničkim ispitivanjima, novije opcije liječenja za HR+/HER2- eBC imale su veće stope simptomatskih neželjenih reakcija u usporedbi s placebom - osobito proljeva, mučnine i umora - što je doprinijelo prekidu u gotovo 1 od 5 bolesnica.7,19,20
Prekid liječenja i nepridržavanje povezani su s povećanim rizikom od recidiva, što naglašava potrebu za liječenjem s poboljšanom podnošljivošću14,21,22
UOČITE JAZ
Značajan rizik od udaljenog recidiva za bolesnice sa stadijem II (N0, N1) ranog karcinoma dojke (eBC) ostaje uglavnom neriješen današnjim tretmanima2,3,8,11,12,14,19-22

Neprepoznat rizik
Dijagnozu stadija II (N0, N1) ima značajan broj HR+/HER2- ranih karcinoma dojke i otprilike 1 od 3 bolesnice je u riziku od udaljenih recidiva.2,3

Jaz u liječenju
Nedavno odobrene terapije su ograničene u porabi na <15% bolesnica, ostavljajući većinu (N0, N1) bolesnica bez optimalne terapije.7-12

Izazovi podnošenja
Gotovo 1 od 5 bolesnica prekida ove terapije zbog problema s podnošljivošću — ostavljajući ih pod povećanim rizikom od recidiva.13-18
Novartis je predan uklanjanju ovog jaza u liječenju bolesnica sa stadijem II (N0, N1) HR+/HER2- eBC23,24
Kratice i reference
KRATICE:
- BRCA - engl. Breast Cancer gen
- eBC - engl. early Breast Cancer, rani karcinom dojke
- ER+ - estrogen receptor pozitivan
- ET - endokrina terapija
- gBRCAm - zametni mutirani Breast Cancer gen
- HER2– - negativan receptor za humani epidermalni faktor rasta tip 2
- HR+ – hormon receptor-pozitivan
- N - limfni čvor (broj limfnih čvorova)
- T - veličina tumora
REFERENCE:
- Pan H, Gray R, Braybrooke J, et al; EBCTCG. 20-year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years. N Engl J Med. 2017;377(19):1836-1846. doi:10.1056/NEJMoa1701830
- Pan H, Gray R, Braybrooke J, et al; EBCTCG. 20-year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years. N Engl J Med. 2017;377(19):1836-1846;(suppl). doi:10.1056/NEJMoa1701830
- Howlader N, Altekruse SF, Li CI, et al. US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status. J Natl Cancer Inst. 2014;106(5):dju055. doi:10.1093/jnci/dju055
- Kalli S, Semine A, Cohen S, Naber SP, Makim SS, Bahl M. American Joint Committee on Cancer’s staging system for breast cancer, eighth edition: what the radiologist needs to know. Radiographics. 2018;38(7):1921-1933. doi:10.1148/rg.2018180056
- Koh J, Kim MJ. Introduction of a new staging system of breast cancer for radiologists: an emphasis on the prognostic stage. Korean J Radiol. 2019;20(1):69-82. doi:10.3348/kjr.2018.0231
- Lüönd F, Tiede S, Christofori G. Breast cancer as an example of tumour heterogeneity and tumour cell plasticity during malignant progression. Br J Cancer. 2021;125(2):164-175. doi:10.1038/s41416-021-01328-7
- Johnston SRD, Harbeck N, Hegg R, et al. Abemaciclib combined with endocrine therapy for the adjuvant treatment of HR+, HER2–, node-positive, high-risk, early breast cancer (monarchE). J Clin Oncol. 2020;38(34):3987-3998. doi:10.1200/JCO.20.02514
- Lynparza [Summary of Product Characteristics]. Pristupljeno srpanj 2023. https://www.ema.europa.eu/en/documents/product-information/lynparza-epar...
- European Medicines Agency. European public assessment reports: Verzenios. Updated April 21, 2023. Pristupljeno srpanj, 2023. https://www.ema.europa.eu/en/medicines/human/EPAR/verzenios
- European Medicines Agency. European public assessment reports: Lynparza. Updated October 3, 2022. Pristupljeno srpanj, 2023. https://www.ema.europa.eu/en/medicines/human/EPAR/lynparza
- Verzenios [Summary of Product Characteristics]. Eli Lilly Nederland B.V.; 2023. Pristupljeno srpanj 2023. https://www.ema.europa.eu/en/documents/product-information/verzenios-epa...
- Hu C, Hart SN, Gnanaolivu R, et al. A population-based study of genes previously implicated in breast cancer. N Engl J Med. 2021;384(5):440-451. doi:10.1056/NEJMoa2005936
- Ahmed N, Vengalasetti Y, Haslam A, Prasad V. Association of adjuvant or metastatic setting with discontinuation of cancer drugs in clinical trials. JAMA Netw Open. 2022;5(5):e2212327. doi:10.1001/jamanetworkopen.2022.12327
- Pistilli B, Lohrisch C, Sheade J, Fleming GF. Personalizing adjuvant endocrine therapy for early-stage hormone receptor-positive breast cancer. Am Soc Clin Oncol Educ Book. 2022;42:60-72. doi:10.1200/EDBK_350358
- Smith KL, Verma N, Blackford AL, et al. Association of treatment-emergent symptoms identified by patient-reported outcomes with adjuvant endocrine therapy discontinuation. NPJ Breast Cancer. 2022;8(1):53. doi:10.1038/s41523-022-00414-0
- Brett J, Fenlon D, Boulton M, et al. Factors associated with intentional and unintentional non-adherence to adjuvant endocrine therapy following breast cancer. Eur J Cancer Care (Engl). 2018;27(1). doi:10.1111/ecc.12601
- Fontein DBY, Nortier JWR, Liefers GJ, et al. High non-compliance in the use of letrozole after 2.5 years of extended adjuvant endocrine therapy. Results from the IDEAL randomized trial. Eur J Surg Oncol. 2012;38(2):110-117. doi:10.1016/j.ejso.2011.11.010
- Hershman DL, Kushi LH, Shao T, et al. Early discontinuation and nonadherence to adjuvant hormonal therapy in a cohort of 8,769 early-stage breast cancer patients. J Clin Oncol. 2010;28(27):4120-4128. doi:10.1200/JCO.2009.25.9655
- Tutt ANJ, Garber JE, Kaufman B, et al; OlympiA Clinical Trial Steering Committee and Investigators. Adjuvant olaparib for patients with BRCA1- or BRCA2-mutated breast cancer. N Engl J Med. 2021;384(25):2394-2405. doi:10.1056/NEJMoa2105215
- Rugo HS, O’Shaughnessy J, Boyle F, et al; monarchE Committee Members. Adjuvant abemaciclib combined with endocrine therapy for high-risk early breast cancer: safety and patient-reported outcomes from the monarchE study. Ann Oncol. 2022;33(6):616-627. doi:10.1016/j.annonc.2022.03.006
- Collin LJ, Cronin-Fenton DP, Ahern TP, et al. Early discontinuation of endocrine therapy and recurrence of breast cancer among premenopausal women. Clin Cancer Res. 2021;27(5):1421-1428. doi:10.1158/1078-0432.CCR-20-3974
- Ejlertsen B, Jensen M-B, Mouridsen HT; Danish Breast Cancer Cooperative Group. Excess mortality in postmenopausal high-risk women who only receive adjuvant endocrine therapy for estrogen receptor positive breast cancer. Acta Oncol. 2014;53(2):174-185. doi:10.3109/0284186X.2013.850738
- A phase III, multicenter, randomized, open-label trial to evaluate efficacy and safety of ribociclib with endocrine therapy as an adjuvant treatment in patients with hormone receptor-positive, HER2-negative, early breast cancer (New Adjuvant TriAl with Ribociclib [LEE011]: NATALEE). EduraCT identifier: 2018-002998-21. Posted January 18, 2019. Pristupljeno srpanj 2023. https://www.clinicaltrialsregister.eu/ctr-search/trial/2018-002998-21/ES
- A trial to evaluate efficacy and safety of ribociclib with endocrine therapy as adjuvant treatment in patients with HR+/HER2- early breast cancer (NATALEE). ClinicalTrials.gov identifier: NCT03701334. Updated February 18, 2022. Pristupljeno srpanj, 2023. https://clinicaltrials.gov/ct2/show/NCT03701334?term=NCT03701334&draw=2&...


